
新冠疫情对知识产权行业的影响是否适用于“不可抗力”?
2020年3月27日
快讯:官宣!2020年全国知识产权宣传周主题活动确定。
2020年3月30日自从疫情爆发以来,关于瑞德西韦的讨论就没有中断过。
最近有一个重大消息传来,瑞德西韦在美获批成为“孤儿药”,但还没等这个消息被捂热,又听说这个吉利德公司主动撤销了申请。
1、什么是孤儿药?
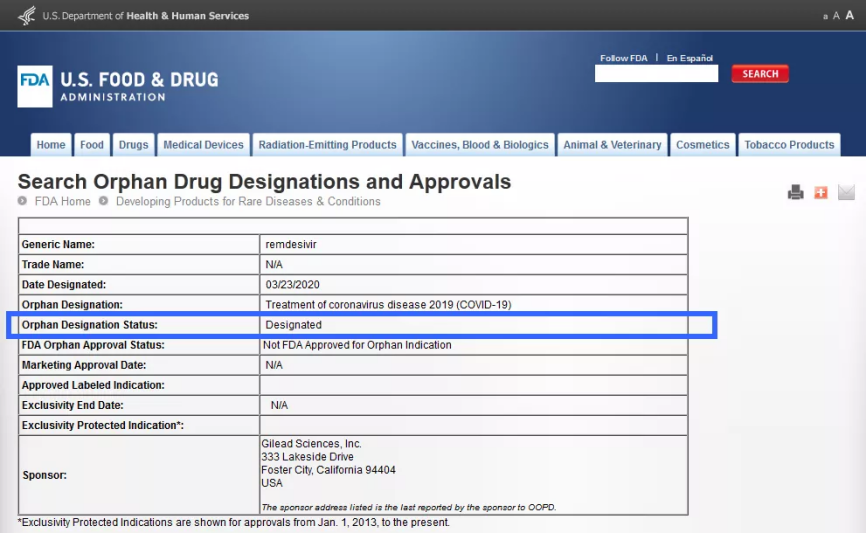
日前,一则吉利德科学公司研制的瑞德西韦在美获批“孤儿药认证(Orphan Drug Designations)”的消息刷遍了朋友圈。
2020年3月初,在疫情开始有了向全球蔓延趋势的时候,吉利德便开始申请将瑞德西韦作为新型冠状病毒肺炎潜在治疗方案的“孤儿药”资格。
这个消息是美国食品药品管理局(FDA)官网发布的,而药品一经获批“孤儿药”后,就意味着药物一旦上市,就可以霸占市场7年,且期间不可被仿制,国家对“孤儿药”还有一系列福利、优惠政策。
那么什么是孤儿药呢?
孤儿药(Orphan drug),是指专门用于治疗或控制罕见病的药物。1983年,为了鼓励药企开发治疗罕见病的药物,美国出台了《孤儿药法案》。因为孤儿药的开发难度大,但同时市场需求小,很多企业开发孤儿药成本难以回收。
因此FDA规定,只要获得了“孤儿药”资格,就能够获得50%的税收抵免、新药申请费减免等其他优惠。此外,孤儿药还拥有一项特权,相关公司可以有高达7年的独占期,美国法律将禁止其他公司仿制这种药物。
2、申请后2天忙撤销
吉利德获得“孤儿药”认证是个大大的利好消息,然而仅仅过了2天,3月25日,吉利德官网发布了一份声明——《请求撤销对瑞德西韦的孤儿药资格》。

在这份声明中,吉利德说:
“今年3月初,吉利德寻求并被授予了瑞德西韦的孤儿药资格,在美国新冠肺炎患者不足20万人的情况下使用。被授予孤儿药资格,可以加快审批新药申请的时间,而这一时间原本长达210天。吉利德认识到新冠病毒大流行带来的紧急公共卫生需求。我们正在努力推进瑞德西韦的研发。”
为什么会这样呢?
原来,上文中说的影响“孤儿药认证”的罕见病,在美国也有明确规定。
2002年通过的《罕见病法案》中将“罕见病”定义为美国患病人数低于20万人的疾病。
可以现在的趋势看,受新冠病毒影响的患者一定会不止20万人,所以这个“孤儿药”能否认证也引发了大家争议。
而美国本土也出现了一大批反对的声音,认为将瑞德西韦申请孤儿药资格是一种非常尴尬的行为。
3、撤销申请是公司做出的最优选择
不得不说,在舆论的风口浪尖上选择撤回“孤儿药”申请,为吉利德公司赢得了一批好感。
美国的吉利德公司成立于1987年,位于美国加利福尼亚州,在研究抗病毒治疗方面大名鼎鼎,所开发和销售的药物广泛应用在治疗病菌传染方面,包括病毒传染、真菌感染和细菌传染,公司还特别关注癌症的治疗。
而瑞德西韦药物,也是吉利德公司研发的专门为了对抗埃博拉病毒的,但后来发现对埃博拉病毒的治疗作用有限,后续研究表明,瑞德西韦对包括非典、中东呼吸综合征等冠状病毒引起的疾病有疗效。
经查询,吉利德公司在2011年-2019年至少申请或被授予了100余件与瑞德西韦相关的专利。围绕化合物结构、治疗方法和药物组合,吉利德公司针对冠状病毒感染也进行了专利申请。
总之,无论是否能够获得“孤儿药”资格,吉利德公司都是大赢家。
如今,中国的抗“疫”战争已经度过了最艰难的阶段,世界的危机却还没有解除,不管怎样,大家都加油,争取早日打赢这场没有硝烟的战争。




